Микромир
Микромир
Атомная физика.
Еще древние греки Левкипп и Демокрит выдвинули гениальную догадку, что вещество состоит из мельчайших частиц – атомов.
Научные основы атомно-молекулярного учения были заложены гораздо позднее в работах русского ученого М.В. Ломоносова, французских химиков Л. Лавуазье и Ж. Пруста, английского химика Дж. Дальтона, итальянского физика А. Авогадро и других исследователей.
Периодический закон Д.И. Менделеева показал существование закономерной связи между всеми химическими элементами. Стало ясно, что в основе всех атомов лежит нечто общее. До конца XIX в. в химии царило убеждение, что атом есть наименьшая неделимая частица простого вещества. Считалось, что при всех химических превращениях разрушаются и создаются только молекулы, атомы же остаются неизменными и не могут дробиться на части. И, наконец, в конце XIX в. были сделаны открытия, показавшие сложность строения атома и возможность превращения одних атомов в другие.
Первыми на сложную структуру атома указали немецкие ученые Г.Р. Кирхгоф и Р.В. Бунзен, изучая спектры испускания и поглощения различных веществ. Сложную структуру атома подтверждали также опыты по изучению ионизации, открытие и исследование так называемых катодных лучей и явления радиоактивности.
Г.Р. Кирхгоф и Р.В. Бунзен обнаружили, что каждому химическому элементу соответствует характерный, присущий только ему набор спектральных линий в спектрах испускания и поглощения. Это означало, что свет испускается и поглощается отдельными атомами, а атом, в свою очередь, представляет собой сложную систему, способную взаимодействовать с электромагнитным полем.
Об этом же свидетельствовало явление ионизации атомов, обнаруженное при исследованиях электролиза и газового разряда. Данное явление можно было объяснить, лишь предположив, что атом в процессе ионизации теряет часть своих зарядов или приобретает новые.
Свидетельством сложной структуры атома явились опыты по изучению катодных лучей, возникающих при электрическом разряде в сильно разреженных газах. Для наблюдения этих лучей из стеклянной трубки, в которую впаяны два металлических электрода, выкачивается, по возможности, весь воздух, а затем сквозь нее пропускается ток высокого напряжения. При таких условиях от катода трубки перпендикулярно к его поверхности распространяются «невидимые» катодные лучи, вызывающие яркое зеленое свечение в том месте, куда они попадают. Катодные лучи обладают способностью приводить в движение легко подвижные тела и отклоняться от своего первоначального пути в магнитном и электрическом полях.
Изучение свойств катодных лучей привело к заключению, что они состоят из мельчайших частиц, несущих отрицательный заряд. Позже удалось определить массу и величину их заряда. Оказалось, что масса частиц и величина их заряда не зависят ни от природы газа, остающегося в трубке, ни от вещества, из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут существовать без своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет самую сущность их природы. Эти частицы получили название электронов.
В катодных трубках электроны отделяются от катода под влиянием электрического поля. Но они могут возникать и вне всякой связи с электрическим полем. Так, например, при электронной эмиссии металлы испускают электроны, при фотоэффекте многие вещества также выбрасывают электроны. Выделение электронов самыми разнообразными веществами указывало на то, что эти частицы входят в состав всех без исключения атомов. Это позволило сделать вывод, что атомы являются сложными образованиями, построенными из более мелких составных частей.
В 1896 г., изучая люминесценцию различных веществ, А.А. Беккерель случайно обнаружил, что соли урана, излучают без предварительного их освещения. Это излучение, обладающее большой проникающей способностью и воздействующее на фотографическую пластинку, завернутую в черную бумагу, было названо радиоактивным излучением. Позднее было установлено, что оно состоит из тяжелых положительно заряженных α-частиц, легких отрицательных β-частиц (электронов) и электрически нейтрального γ-излучения.
Открытие электрона можно считать началом рождения атомной физики, обусловившим попытки построения моделей атома. Поскольку электрон имеет отрицательный заряд, а атом в целом устойчив и электронейтрален, то естественно было предположить наличие в атоме положительно заряженных частиц.
Первые модели атома на основе представлений классической механики и электродинамики появились в 1904 г.: автором одной из них стал японский физик Хантаро Нагаока, другая принадлежала английскому физику Дж. Томсону – автору открытия электрона.
X. Нагаока представил строение атома аналогичным строению Солнечной системы: роль Солнца играет положительно заряженная центральная часть атома, вокруг которой по установленным кольцеобразным орбитам движутся «планеты» – электроны. При незначительных смещениях электроны возбуждают электромагнитные волны.
В модели атома Дж. Томсона положительное электричество «распределено» по сфере, в которую вкраплены электроны. В простейшем атоме водорода электрон находится в центре положительно заряженной сферы. В многоэлектронных атомах электроны располагаются по устойчивым конфигурациям, рассчитанным Дж. Томсоном. Томсон считал, что каждая конфигурация определяет те или иные химические свойства атомов. Он предпринял попытку теоретически объяснить периодическую систему элементов Д. И. Менделеева.
Но вскоре оказалось, что новые опытные факты опровергают модель Томсона и, наоборот, свидетельствуют в пользу планетарной модели. Эти факты были установлены Э. Резерфордом в 1912 г. В первую очередь следует отметить открытие им атомного ядра. Для выявления структуры атома Резерфорд производил зондирование атома с помощью α–частиц, которые возникают при распаде радия и некоторых других радиоактивных элементов. Их масса примерно в 8000 раз больше массы электрона, а положительный заряд равен по модулю удвоенному заряду электрона.
В опытах Резерфорда пучок α–частиц падал на тонкую фольгу из исследуемого материала (золото, медь и др.). После прохождения фольги α–частицы попадали на экран, покрытый сульфидом цинка. Столкновение каждой частицы с экраном сопровождалось сцинтилляцией (вспышкой света), которую можно было наблюдать. В отсутствие фольги на экране возникал светлый кружок, состоящий из сцинтилляций, вызванных пучком частиц. Но когда на пути пучка помещали фольгу, то вопреки ожиданиям α–частицы испытывали очень малое рассеяние на атомах фольги и распределялись на экране внутри круга чуть большей площади.
Совершенно неожиданным также оказалось, что небольшое число α–частиц (примерно одна из двадцати тысяч) отклонялись на углы больше 90°, т.е. практически возвращались назад. Резерфорд понял, что положительно заряженная α–частица могла быть отброшена назад лишь в том случае, если в атомах мишени положительный заряд атома и его масса сконцентрированы в очень малой области пространства. Так Резерфорд пришел к идее атомного ядра – тела малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома.
Подсчитывая число α–частиц, рассеянных на большие углы, Резерфорд смог оценить размеры ядра. Оказалось, что ядро имеет диаметр порядка
10–12–10–13 см (у разных ядер). Размер же самого атома составляет примерно 10–8 см, т.е. в 10 – 100 тысяч раз превышает размеры ядра. Впоследствии удалось точно определить и заряд ядра. Если принять заряд электрона за единицу, то заряд ядра оказался в точности равен номеру данного химического элемента в периодической системе элементов Д.И. Менделеева.
Из опытов Резерфорда непосредственно вытекала планетарная модель атома с положительно заряженным атомным ядром. Учитывая, что в целом атом должен быть электронейтральным, следовало заключить, что число внутриатомных электронов, как и заряд ядра, равно порядковому номеру элемента в периодической системе. Очевидно также, что находиться в покое электроны внутри атома не могут, так как они вследствие притяжения положительным ядром упали бы на него. Следовательно, они должны двигаться вокруг ядра подобно планетам вокруг Солнца. Такой характер движения электронов определяется действием электрических кулоновских сил со стороны ядра.
В атоме водорода вокруг ядра обращается всего лишь один электрон. Ядро атома водорода имеет положительный заряд, равный по модулю заряду электрона, и массу примерно в 1836 раз большую массы электрона. Это ядро было названо Резерфордом протоном и стало рассматриваться как элементарная частица.
Размер атома определяется радиусом орбиты движения его электронов. Достаточно наглядная планетарная модель атома, как уже говорилось, является прямым следствием экспериментальных результатов Резерфорда по рассеянию α-частиц на атомах вещества.
Однако вскоре выяснилось, что такая простая модель противоречит законам электродинамики, из которых следует, что модель атома Резерфорда является неустойчивой системой и длительное время атом указанной конструкции существовать не может. Дело в том, что движение электронов по круговым орбитам происходит с ускорением, а ускоренно движущийся заряд, согласно законам электродинамики Максвелла, должен излучать электромагнитные волны (ω – частотой, равной частоте его обращения вокруг ядра). Излучение сопровождается потерей энергии. Теряя энергию, электроны должны приближаться к ядру, подобно тому, как спутник приближается к Земле при торможении в верхних слоях атмосферы.
В действительности, однако, этого не происходит. Атомы устойчивы, могут существовать неограниченно долго, совершенно не излучая электромагнитные волны.
Выход из создавшегося положения нашел датский ученый Н.
Бор. Он сделал радикальный вывод о том, что законы классической механики и электродинамики вообще не применимы в микромире и, в частности, в атоме. Тем не менее, чтобы сохранить планетарную модель атома Резерфорда, он сформулировал два постулата (постулаты Бора), идущие вразрез и с классической механикой, и с классической электродинамикой. Эти постулаты заложили основы принципиально новых теорий микромира – квантовой механики и квантовой электродинамики (квантовой теории электромагнитного поля). Обосновывая свои постулаты, Бор опирался на идею существования квантов электромагнитного поля, выдвинутую в 1900 г. М. Планком и развитую затем А. Эйнштейном (для объяснения фотоэффекта).
Постулаты Бора заключаются в следующем: электрон может двигаться вокруг ядра не по любым орбитам, а только по таким, которые удовлетворяют определенными условиям, вытекающим из теории квантов. Эти орбиты получили название устойчивых, или квантовых, орбит. Когда электрон движется по одной из возможных для него устойчивых орбит, то он не излучает. Переход электрона с удаленной орбиты на более близкую орбиту сопровождается потерей энергии.
Потерянная атомом при каждом переходе энергия превращается в один квант лучистой энергии. Частота излучаемого при этом света определяется радиусами тех двух орбит, между которыми совершается переход электрона. Чем больше расстояние от орбиты, на которой находится электрон, до орбиты, на которую он переходит, тем больше частота излучения.
Простейшим из атомов является атом водорода: вокруг ядра вращается только один электрон. Исходя из приведенных постулатов Бор рассчитал радиусы возможных орбит для этого электрона и нашел, что они относятся, как квадраты натуральных чисел: 1:2: : 3 : … : п. Величина п получила название главного квантового числа. Радиус ближайшей к ядру орбиты в атоме водорода равняется 0,53 ангстрема. Вычисленные отсюда частоты излучений, сопровождающих переходы электрона с одной орбиты на другую, оказались точности совпадающими с частотами, найденными опытным путем для линий водородного спектра. Тем самым была доказана правильность расчета устойчивых (стационарных) орбит для атома водорода, вместе с тем и приложимость постулатов Бора для таких расчетов.
В дальнейшем теория Бора была распространена и на атомную структуру других элементов. Однако распространение теории на многоэлектронные атомы и молекулы столкнулось с трудностями. Чем подробнее теоретики пытались описать движение электронов в многоэлектронном атоме, определить их орбиты, тем большими были расхождения результатов с экспериментальными данными. В ходе развития квантовой теории стало ясно, что эти расхождения носят принципиальный характер и связаны с так называемыми волновыми свойствами электрона.
Дело в том, что в 1924 г. Луи де Бройль распространил известный к тому времени корпускулярно-волновой дуализм электромагнитного поля на вещественные частицы микромира (атомы, электроны, протоны и т.д.). Напомним, что согласно его идее частицы, имеющие массу, заряд и т.д., также обладают и волновыми свойствами. При этом длина волны де Бройля (λ) связана с импульсом частиц р и равна
λ = h/р, где h – постоянная Планка.
Идея де Бройля нашла блестящее подтверждение в опытах К. Дэвиссона и Л. Джермера (1927), в которых наблюдалось явление дифракции электронов – классический пример волнового явления.
Развивая волновые идеи частиц микромира, Э. Шрёдингер создал математическую волновую модель атома в виде знаменитого сейчас волнового дифференциального уравнения Шрёдингера:
Анализ волнового уравнения Шрёдингера показал, что с его помощью можно определить все возможные дискретные энергии Еп
в атоме. Кроме того, было выяснено, что волновая функция не позволяет абсолютно точно определить положение электронов в атомах, они расплываются в некое «облако»; таким образом, можно говорить лишь о вероятности нахождения электронов в том или ином месте атома, которая характеризуется квадратом амплитуды волны.
Учитывая законы квантовой волновой механики, становится ясно, почему оказалось невозможным точно описать структуру атома на основе представлений о боровских орбитах электронов в атоме. Таких, точно локализованных орбит в атомах просто не существует, а хорошее согласование расчета орбит электронов в атоме водорода, в соответствии с теорией Бора и экспериментальными данными связано с тем, что только для атома водорода электронные орбиты Бора хорошо совпали с кривыми средней плотности зарядов, вычисленных в соответствии с квантовой теорией Шрёдингера. Для многоэлектронных атомов такого совпадения не наблюдается.
В настоящее время на основе квантовой механики, а также квантовой электродинамики – квантовой теории электромагнитного поля, разработанной в 1927 г. П.А. Дираком, удалось объяснить многие особенности поведения многоэлектронных атомно-молекулярных систем. В частности, удалось разрешить важнейший вопрос о структуре атомов различных элементов и установить зависимость свойств элементов от строения электронных оболочек им атомов. В настоящее время разработаны схемы строения атомов всех химических элементов, которые позволяют объяснить многие физические и химические свойства элементов.
Напомним, что число электронов, вращающихся вокруг ядра атома, соответствует порядковому номеру элемента в периодической системе Д.И. Менделеева. Электроны расположены послойно. Каждому слою принадлежит определенное заполняющее или как бы насыщающее его число электронов. Электроны одного и того же слоя характеризуются близкими значениями энергии, т.е. находятся примерно на одинаковом энергетическом уровне. Вся оболочка атома распадается на несколько энергетических уровней (n). Электроны каждого последующего слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего слоя. Максимальное число электронов (N), могущих находиться на данном энергетическом уровне (n), определяется по формуле N = 2n2, т.е. на первом уровне (n=1) может находиться два электрона, на втором (п = 2) – восемь электронов, на третьем (n= 3) – восемнадцать.
Электроны наружного слоя, как наиболее удаленные от ядра и, следовательно, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся заряженными положительно, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот, атомы, присоединившие электроны, становятся заряженными отрицательно. Образующиеся заряженные частицы называются ионами. Многие ионы, в свою очередь, могут терять или присоединять электроны, превращаясь при этом в электронейтральные атомы или новые ионы с иным зарядом.
Подводя итог рассмотрению основных результатов квантово-механических подходов к строению и структуре атомов, отметим следующее. Состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами – n, l, т, s:
-
n – главное квантовое число, характеризует энергию электрона на соответствующей орбите (n);
-
l – орбитальное квантовое число, характеризует форму орбиты (электронного облака) и может изменяться в атоме от 0 до n = 1;
-
т – магнитное квантовое число, характеризует ориентацию орбит
(электронных облаков) в пространстве и может принимать значения от +1 до –1;
-
s – спиновое квантовое число, характеризует вращение электрона вокруг собственной оси и может принимать только два значения: s = ±1/2.
Согласно одному из важнейших принципов квантовой механики – принципу Паули, в атоме не может быть электронов, у которых все четыре квантовых числа одинаковы. В рамках квантовой механики получили полное объяснение, как структура атомов, так и изменение свойств химических элементов в периодической системе Д.И. Менделеева.
Плодотворным оказалось также применение квантовой механики к физическим полям. Была построена квантовая теория электромагнитного поля – квантовая электродинамика, вскрывшая целый ряд фундаментальных законов микромира. Среди них важнейшие законы взаимного превращения двух видов материальных субстанций – вещественной и полевой материи – друг в друга.
Свое место в ряду элементарных частиц занял фотон – частица электромагнитного поля, не имеющая массы покоя. Синтез квантовой механики и специальной теории относительности привел к предсказанию существования античастиц. Оказалось, что у каждой частицы должен быть как бы свой «двойник» – другая частица с той же массой, но противоположным электрическим или каким-либо другим зарядом. Английский физик П.А. Дирак – основатель релятивистской к пантовой теории поля – предсказал существование позитрона и возможность превращения фотона в пару электрон-позитрон и обратно. Позитрон – античастица электрона – экспериментально был открыт и 1934 г. К.Д. Андерсоном в космических лучах.
Ядерная физика.
По современным представлениям, атомные ядра элементов состоят из протонов и нейтронов. Первые указания на то, что и состав ядер входят протоны (ядра атомов водорода) были получены Резерфордом в 1919 г. в результате его нового (после открытия строения атома) сенсационного открытия – расщепления атомного ядра под действием α-частиц и получения новых химических элементов в результате первой искусственной ядерной реакции.
В одном из вариантов своих опытов с использованием камеры Вильсона, наполненной азотом, внутри которой имелся радиоактивный источник излучения, Резерфордом были получены фотографии треков α-частиц, на конце которых имелось характерное разветвление – «вилка». Одна из сторон «вилки» давала короткий трек, а другая – длинный. Длинный трек имел такие же особенности, как и треки, наблюдаемые ранее Резерфордом при бомбардировке α-частицами атомов водорода
Так впервые была высказана мысль, что ядра водорода представляют собой составную часть ядер других атомов. Впоследствии Резерфорд для этой составной части ядра предложил термин «протон».
Схема реакции Резерфорда может быть представлена следующим образом: α–частица попадает в атомное ядро азота
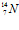 и поглощается им. Образующееся при этом промежуточное ядро изотопа фтора
и поглощается им. Образующееся при этом промежуточное ядро изотопа фтора 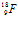 оказывается неустойчивым: оно выбрасывает из себя один протон, превращаясь в ядро изотопа кислорода
оказывается неустойчивым: оно выбрасывает из себя один протон, превращаясь в ядро изотопа кислорода 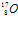 .
.
В 1932 г. Д.Д. Иваненко опубликовал заметку, в которой высказал предположение, что наряду с протоном структурным элементом ядра также является нейтрон. В 1933 г. он обосновал протон-нейтронную модель ядра и сформулировал основной тезис, заключающийся в том, что в ядре имеются только тяжелые частицы – протоны и нейтроны. При этом обе частицы могут превращаться друг в друга. В дальнейшем протон и нейтрон стали рассматривать как два состояния одной частицы – нуклона.
А в том же 1933 г. Дж. Чедвик экспериментально доказал существование нейтронов в атомных ядрах. Он облучал α–частицами бериллиевую пластинку и исследовал реакцию превращения бериллия (Be) в углерод (С) с испусканием нейтрона n).
Нейтроны, вылетающие из бериллия, направлялись в камеру Вильсона, наполненную азотом (N), и при попадании нейтрона в и протон атома азота образовывалось ядро бора (В) и α–частицы .
Сам нейтрон не дает трека в камере Вильсона, но по трекам ядра бора и α–частицы можно рассчитать, что данная реакция вызвана нейтральной частицей массой в одну атомную единицу массы, т.е. нейтроном. Отметим, что свободный нейтрон существует недолго, он радиоактивен, период его полураспада составляет около 8 мин, после чего он превращается в протон, испуская β–частицу (электрон) и нейтрино. После открытия нейтрона протон-нейтронная модель строения атомных ядер Д.Д. Иваненко стала общепризнанной.
Все ядерные реакции сопровождаются испусканием тех или иных элементарных частиц. Продукты ядерных реакций оказываются радиоактивными, их называют искусственно радиоактивными изотопами. Явление искусственной радиоактивности было открыто в 1934 г. известными французскими физиками Фредериком и Ирен Жолио-Кюри.
Как и естественно радиоактивные вещества, искусственно полученные радиоактивные изотопы испускают известные α, β, и γ–излучения. Но кроме перечисленных излучений Фредерик и Ирен Жолио-Кюри открыли новый вид радиоактивности – испускание положительных электронов-позитронов.
Впервые это удалось установить с помощью камеры Вильсона при бомбардировке α–частицами некоторых легких элементов (бериллия, бора, алюминия), в результате чего был искусственно создан целый ряд новых радиоактивных изотопов, не наблюдаемых ранее в природе. Примером образования позитронного радиоактивного изотопа может служить реакция бомбардировки алюминия α–частицами. И данном случае ядро алюминия
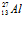 испускает нейтрон и превращается в ядро радиоактивного изотопа фосфора
испускает нейтрон и превращается в ядро радиоактивного изотопа фосфора 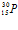 , который в свою очередь, испуская позитрон β+, превращается в стабильный изотоп кремния
, который в свою очередь, испуская позитрон β+, превращается в стабильный изотоп кремния 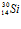 .
.
В промышленном масштабе искусственные радиоактивные изотопы обычно получают облучением (главным образом нейтронным) соответствующих химических элементов в ядерных реакторах.
После того, как было установлено, что ядра атомов состоят и протонов и нейтронов, теория атомного ядра получила дальнейшее развитие в направлении изучения взаимодействий частиц внутри ядра, а также структуры атомных ядер различных элементов.
Ниже приведены основные сведения о свойствах и строении ядер.
1. Ядром называется центральная часть атома, в которой сосредоточена практически вся масса атома и его положительный электрический заряд. Все атомные ядра состоят из протонов и нейтронов, которые считаются двумя зарядовыми состояниями одной частицы – нуклона.
Протон имеет положительный электрический заряд, равный по абсолютной величине заряду электрона е=1,6 –19 Кл и массу покоя тр ~ 1,6726 • 10 –27кг.
Нейтрон не имеет электрического заряда, его масса немног больше массы протона – тп
= 1,6749 • 10 –27 кг.
Массу ядер элементарных частиц обычно выражают в атомных единицах массы (а.е.м.). За атомную единицу массы принята 1/12
массы изотопа углерода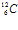 : 1 а.е.м. = 1,66 • 10 –27 кг. Следовательно, тр
: 1 а.е.м. = 1,66 • 10 –27 кг. Следовательно, тр
= 1,00728 а.е.м., а тп
= 1,00866 а.е.м.
2. Зарядом ядра называется величина Ze, где е –
величина заряда протона; Z – порядковый номер химического элемента в периодической системе Менделеева, равный числу протонов в ядре.
В настоящее время известны ядра с порядковым номером Z = 1 до Z = 114. Для легких ядер отношение числа нейтронов (N) к числу протонов (Z) близко или равно единице. Для ядер химических элементов, расположенных в конце периодической системы, отношение N/Z = 1,6.
3. Общее число нуклонов в ядре А = N + Z называется массовым числом. Нуклонам (протону и нейтрону) приписывается массовое число, равное единице. Ядра с одинаковыми Z, но различными А называются изотопами. Ядра, которые при одинаковом А имеют различные Z, называются изобарами. Ядра химических элементов принято обозначать символом .X, А, Z где X – символ химического элемента; А – массовое число; Z – атомный номер.
Всего известно около 300 устойчивых изотопов химических элементов и более 2000 естественных и искусственно полученных paдиоактивных изотопов.
Все изотопы одного химического элемента имеют одинаковое строение электронных оболочек. Поэтому у изотопов данного элемента одинаковы все химические свойства. В настоящее время установлено, что большинство химических элементов, встречающих в природе, представляет собой смесь изотопов. Поэтому указанные в таблице Менделеева атомные массы элементов часто значительно отличаются от целых чисел.
4. Размер ядра характеризуется радиусом ядра, имеющим условный смысл ввиду размытости границ ядра. Эмпирическая формула для радиуса ядра R = R А, где R= (1,3/1,7)10 –15 м, может быть истолкована как пропорциональность объема ядра числу нуклонов в нем.
5. Ядерные частицы имеют собственные магнитные моменты, которыми определяется магнитный момент ядра (Ртт) в целом. Единицей измерения магнитных моментов ядер служит ядерный магнетон μ яд = eh,/2тр, где е – абсолютная величина заряда электрона; h – постоянная Планка; тр
– масса протона. Ядерный магнетон μ яд в 1836,5 раза меньше магнитного момента электрона в атоме, откуда следует, что магнитные свойства атомов определяются магнитными свойствами его электронов.
6. Распределение электрического заряда протонов по ядру в общем случае несимметрично. Мерой отклонения этого распределения сферически симметричного является квадруполъный электрический момент ядра Q. Если плотность ядра считать везде одинаковой, то Q определяется только формой ядра.
Нуклоны, составляющие ядро, связаны между собой особыми силами притяжения – ядерными силами. Устойчивость атомных ядер большинства элементов свидетельствует о том, что ядерные силы исключительно велики: они должны превышать значительные кулоновские силы отталкивания, действующие между протонами, расположенными на расстояниях порядка 10–13 см (порядок размеров ядра). Ядерные силы – силы особого рода, связанные с существованием внутри ядра особого вида материи – ядерного поля.
В настоящие время принята мезонная теория ядерных сил, согласно которой нуклоны взаимодействуют друг с другом путем обмена особыми элементарными частицами – π–мезонами – квантами ядерного поля.
Наличие обменных частиц в ядре – мезонов – вначале было предсказано теоретически японским ученым Хидоки Юкавой в 1936 г., а затем открыто в космических лучах в 1947 г.
Общая характеристика ядерных сил сводится к следующему.
1. Ядерные силы являются короткодействующими силами. Они проявляются лишь на весьма малых расстояниях между нуклонами ядра порядка 10 –15 м. Длина (1,5 ÷
2,2) –10 –15 м называется радиусом действия ядерных сил.
2. Ядерные силы обнаруживают зарядовую независимость: притяжение между двумя нуклонами одинаково независимо от зарядового состояния нуклонов – протонного или нуклонного. Зарядовая независимость ядерных сил видна из сравнения энергий в зеркальных ядрах (так называются ядра, в которых общее число нуклонов одинаково, но число протонов в одном равно числу нейтронов в другом).
3. Ядерные силы обладают свойством насыщения, которое проявляется в том, что нуклон в ядре взаимодействует лишь с ограниченным числом ближайших к нему соседних нуклонов. Именно поэтому наблюдается линейная зависимость энергий связи ядер от их массовых чисел А. Практически полное насыщение ядерных сил достигается у α–частицы, которая является очень устойчивым образованием.
Нуклоны прочно связаны в ядре ядерными силами. Для разрыва этой связи, т.е. для полного разобщения нуклонов, нужно совершить значительную работу. Энергия, необходимая для разобщения нуклонов, составляющих ядро, называется энергией связи ядра. Величину энергии связи можно определить на основе закона сохранения энергии и закона пропорциональности массы и энергии в соответствии с формулой Эйнштейна Е = тс2.
Согласно закону сохранения энергии, энергия нуклонов, связанных в ядре, должна быть меньше энергии разобщенных нуклонов на величину энергии связи ε0. С другой стороны, согласно закону пропорциональности массы и энергии, изменение энергии системы ΔW должно сопровождаться пропорциональным изменением массы системы на Δm, т.е. ΔW = Δmc2, где с – скорость света в вакууме.
Так как в данном случае ΔW есть энергия связи ядра, то масса атомного ядра должна быть меньше суммы масс нуклонов, составляющих ядро, на величину Δm, которая называется дефектом массы ядра. Из соотношения ΔW = Δmc2 можно рассчитать энергию связи ядра, если известен дефект массы этого ядра Δm.
В качестве примера рассчитаем энергию связи ядра атома гелия. Оно состоит из двух протонов и двух нейтронов. Масса протона тр
= 1,0073 а.е.м., масса нейтрона – тп
= 1,0087 а.е.м. Следовательно, масса нуклонов, образующих ядро, равна 2тр + 2 тп = 4,0320 а.е.м. Масса же ядра атома гелия тя = 4,0016 а.е.м. Таким образом, дефект масс атомного ядра гелия равен Δm = 4,0320 – 4,0016 = 0,03 а.е.м., или Δm = 0,03 • 1,66 • 10~27 = 5 • 10~29 кг. Тогда энергия связи ядра гелия
ΔW = Δmc2 =510-29 9-1016Дж=28 МэВ.
Общая формула для расчета энергии связи любого ядра (в джоулях) будет иметь вид:
ΔW = c2{[Z-mp+{A-Z)mn]- тя},
где Z– атомный номер; А — массовое число.
Энергия связи ядра, приходящаяся на один нуклон, называется удельной энергией связи (ε). Следовательно, ε=ΔW/А (удельная энергия связи) характеризует устойчивость атомных ядер. Чем больше s, тем устойчивее ядро.
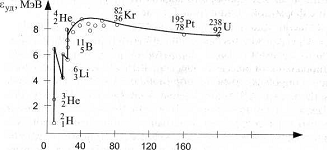
На рис. 1 представлены результаты расчетов удельных энергий связи для разных атомов (в зависимости от массовых чисел А).
Из графика на рис. 2.2 следует, что удельная энергия связи максимальна (8,65 МэВ) у ядер с массовыми числами порядка 100. У тяжелых и легких ядер она несколько меньше (например, 7,5 МэВ у урана и 7 МэВ у гелия), у атомного ядра водорода
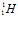 удельная энергия связи равна нулю, что вполне понятно, потому что в этом ядре нечего разобщать: оно состоит только из одного нуклона (протона).
удельная энергия связи равна нулю, что вполне понятно, потому что в этом ядре нечего разобщать: оно состоит только из одного нуклона (протона).
 а.е.м.
а.е.м.
Рис. 1. Зависимость удельных энергий связи от массовых чисел
Всякая ядерная реакция сопровождается выделением или поглощением энергии. При делении тяжелых ядер с массовыми числами А порядка 100 (и более) ядерная энергия выделяется.
Выделение ядерной энергии происходит и при ядерных реакционного типа – при объединении (синтезе) нескольких легких ядер в одно ядро. Таким образом, выделение ядерной энергии происходит как при реакциях деления тяжелых ядер, так и при реакциях синтеза легких ядер. Количество ядерной энергии Δε, выделяемое каждым прореагировавшим ядром, равно разности между энергией связи ε продукта реакции и энергией связи исходного ядерного материала.
Соотношение ∆E∆t>ħ/2 означает, что преобразование энергии с точностью ∆Е должно занять интервал времени равный, по меньшей мере, ∆t~ ħ/∆E. Это соотношение ответственно за естественную ширину спектральных линий атомов и ионов. Время жизни возбужденного состояния атомов имеет порядок t~10-8÷10-9с. Следовательно, неопределенность энергии таких состояний составляет ∆E~ ħ/t,
чему соответствует естественная ширина спектральных линий. Если неопределенность энергии ∆Е ~ ħ/∆t соответствует энергии некоторой частицы (mс2, hv), to эта частица, возникнув из «ничего», может находиться в виртуальном состоянии время ∆t без нарушения закона сохранения энергии. В современной квантовой теории поля взаимодействие частиц и их взаимные превращения рассматриваются как рождение или поглощение каждой реальной частицей виртуальных частиц. Любая частица непрерывно испускает или поглощает виртуальные частицы разных типов. Так, например, электромагнитное взаимодействие – результат обмена виртуальными фотонами, гравитационное – гравитонами. Поле ядерных сил обусловлено виртуальными π–мезонами. Слабое взаимодействие создают векторные бозоны (открытые в 1983 году в ЦЕРНе, Швейцария-Франция). А переносчиком сильного взаимодействия являются глюоны (от английского слова, означающего «клей»). Соотношение неопределенностей ограничивает применимость классической механики к микрообъектам. Оно вызвало многочисленные философские дискуссии. Координаты частицы и ее импульс, изменение энергии и время, в течение которого произошло это изменение, называются взаимно дополнительными величинами. Получение экспериментальной информации об одних физических величинах, описывающих микрочастицу, неизбежно связано с потерей информации о других величинах, дополнительных к первым. Это утверждение, впервые сформулированное датским физиком Н. Бором, называется принципом дополнительности. Бор объяснял принцип дополнительности влиянием измерительного прибора, который всегда является макроскопическим прибором, на состояние микрообъекта. Однако с позиций современной квантовой теории, состояния, в которых взаимно дополнительные величины имели бы одновременно точно определенные значения, принципиально невозможны. Принцип дополнительности отражает объективные свойства квантовых систем, не связанные с существованием наблюдателя, а роль измерительного прибора заключается в «приготовлении» некоторого состояния системы. Любая новая теория, претендующая на более глубокое описание физической реальности и на более широкую область применения, чем старая, должна включать предыдущую как предельный случай. Так релятивистская механика (специальная теория относительности) в пределе малых скоростей переходит в ньютоновскую. В квантовой механике принцип соответствия
требует совпадения ее физических следствий в предельном случае с результатами классической теории. В принципе соответствия проявляется тот факт, что квантовые эффекты существенны лишь при рассмотрении микрообъектов, когда величины размерности действия сравнимы с постоянной Планка. С формальной точки зрения принцип соответствия означает, что в пределе ħ → 0 квантовомеханическое описание физических объектов должно быть эквивалентно классическому. Значение принципа соответствия выходит за рамки квантовой механики – он войдет составной частью в любую новую теоретическую схему. В современной физике термин «элементарные частицы» обычно употребляется не в своем точном значении, а менее строго – для наименования большой группы мельчайших частиц материи, которые не являются атомами или атомными ядрами (исключение составляет протон). Наиболее важное свойство всех элементарных частиц – способность рождаться и уничтожаться (испускаться и поглощаться) при взаимодействии с другими частицами. Сейчас общее число известных науке элементарных частиц (вместе с античастицами) приближается к 400. Некоторые из них стабильны и существуют в природе в свободном или слабосвязанном состоянии. Это – электроны, протоны, нейтроны, фотоны и различного сорта нейтрино.
Все остальные элементарные частицы крайне нестабильны и образуются во вторичных космических лучах или получаются в лаборатории.
Основной способ их генерации – столкновения быстрых стабильных частиц, в процессе которых часть начальной кинетической энергии превращается в энергию покоя образующихся частиц (как правило, не совпадающих со сталкивающимися).
Общими характеристиками всех элементарных частиц являются масса m, время жизни
t, спин J и электрический заряд Q.
В зависимости от времени жизни элементарные частицы делятся на стабильные, квазистабильные и нестабильные (резонансы). Стабильными в пределах точности современных измерений являются электрон (t > 5 • 1021 лет), протон (t > 5 • 10 31 лет), фотон и нейтрино. К квазистабильным относятся частицы, распадающиеся за счет электромагнитного и слабого взаимодействий, их времена жизни t > 5 • 10-20 с. Пример квазистабильной частицы – нейтрон.
Он распадается из-за слабого взаимодействия, среднее время жизни – 15,3 мин:
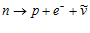 .
.
Резонансами называют элементарные частицы, распадающиеся за счет сильного взаимодействия; их характерные времена жизни t~ 10-22- 10-24 с.
Электрические заряды элементарных частиц являются целыми кратными величины е≈1,6-10-19 Кл, называемой элементарным электрическим зарядом (зарядом электрона). У известных элементарных частиц Q
= 0, ±1, ±2.
Спин элементарных частиц является целым или полуцелым кратным постоянной Планка ħ.
Частицы с полуцелым спином называются фермионами.
К фермионам относятся лептоны (например, электрон и нейтрино) и барионы,
состоящие из кварков
(например, протон и нейтрон). Системы фермионов описываются квантовой статистикой Ферми-Дирака. Фермионы подчиняются принципу запрета Паули и в данном квантовом состоянии системы фермионов не может, находится более одной час-тицы. Фермионы образуют материальные структуры.
Частицы с целым или нулевым спином называются бозонами.
К бозонам относятся частицы с нулевой массой покоя (фотон, гравитон), а также мезоны, состоящие из кварков (например π–мезоны). Системы таких частиц описываются статистикой Бозе-Эйнштейна. Бозоны не подчиняются принципу запрета Паули и для них не накладывается ограничения на число частиц, которые могут находиться в некотором квантовом состоянии. Они образуют поле взаимодействия (согласно квантовой теории поля) между фермионами.
Так, например, материальные структуры образованы электронами и нуклонами (протонами и нейтронами, образующими ядра атомов), а электромагнитное поле взаимодействия между ними образуют фотоны (точнее сказать виртуальные фотоны) (рис. 2).
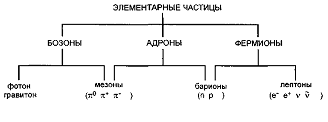
Рис.2.
Классификация элементарных частиц
Мезоны и барионы состоят из кварков, и поэтому имеют общее название – адроны.
Все известные адроны состоят либо из пары кварк-антикварк (мезоны), либо из трех кварков (барионы). Кварки и антикварки удерживаются внутри адронов глюонным полем. Кварки различаются по «аромату» и «цвету». Каждый кварк может находиться в одном из трех цветовых состояний: «красном», «синем» и «желтом». Что касается «ароматов», то их известно 5 и предполагается наличие шестого. Ароматы кварков обозначаются буквами u, d, s, с, b, t, которые соответствуют английским словам up, down, strange, charmed, beaty и truth. Более того, каждому кварку соответствует его антикварк. Ни один кварк, ни разу не был Зарегистрирован в свободном виде, несмотря на многолетние поиски. Кварки можно наблюдать только внутри адронов.
Физика элементарных частиц базируется на понятии о фундаментальных взаимодействиях гравитационном, электромагнитном, сильном и слабом.
Электромагнитное взаимодействие обусловлено обменом фотонами, которые изучены лучше остальных бозонов. Источник фотонов – электрический заряд. Гравитационное взаимодействие связано с пока гипотетическими частицами – гравитонами. Нейтральный (Z 0) и заряженные (W +,W –)бозоны являются переносчиками слабого взаимодействия между электронами, протонами, нейтронами и нейтрино. Переносчиками сильного взаимодействия являются глюоны. Они как бы склеивают кварки в адронах. Источники глюонов – так называемые «цветовые» заряды. Они не имеют никакого отношения к обычным цветам и названы так для удобства описания. Каждый из шести ароматов кварков существует в трех цветовых разновидностях: желтой, синей или красной (ж, с,
к соответственно). Антикварки тоже несут цветовые антизаряды. Важно подчеркнуть, что три заряда и три антизаряда совершенно не зависят от ароматов кварков. Таким образом, в настоящее время полное число кварков и антикварков (с учетом трех цветов и шести ароматов достигло 36. Кроме того, имеется еще девять глюонов. Глюоны, как и кварки, не наблюдаются в свободном состоянии.
Существование кварков и глюонов приводит к появлению нового, состояния вещества, которое носит название кварк-глюонной плазмы.
Это плазма, состоящая не из электронов и ионов, как обычная плазма, а из кварков и глюонов, слабо взаимодействующих друг с другом или не взаимодействующих вообще.
Одной из главных задач микрофизики, о решении которой мечтал еще А. Эйнштейн, является создание единой теории поля, которая объединила бы все известные фундаментальные взаимодействия. Создание такой теории означало бы фундаментальный прорыв во всех областях науки.
К настоящему времени создана и признана теория, которая объединяет два фундаментальных взаимодействия – слабое и электромагнитное. Она называется единой теорией слабого и электромагнитного (электрослабого) взаимодействия и утверждает, что существуют особые частицы – переносчики взаимодействия между электронами, протонами, нейтронами, нейтрино. Эти частицы, названные бозонами W+, W–
и Z°, были теоретически предсказаны в 70-х гг. прошлого века и экспериментально обнаружены в 1983 г.
Теория сильного взаимодействия именуется квантовой хромодинамикой. Данная теория, описывающая взаимодействие кварков и глюонов, построена по образу квантовой электродинамики, которая, в свою очередь, описывает электромагнитные взаимодействия, обусловленные обменом фотонами. В отличие от электрически нейтральных фотонов, глюоны являются носителями «цветовых» зарядов. Это приводит к тому, что при попытке развести их в пространстве энергия взаимодействия возрастает. В результате глюоны и кварки не существуют в свободном состоянии: они «самозапираются» внутри адронов.
Современную теорию элементарных частиц, состоящую из теорий электрослабого взаимодействия и квантовой хромодинамики, принято называть стандартной моделью. Эта сложная, но уже почти законченная феноменологическая теория – главный теоретический инструмент, с помощью которого решаются задачи микрофизики
«Великое объединение» – так называют теоретические модели, исходящие из представлений о единой природе сильного, слабого и электромагнитного взаимодействий. Оно призвано объединить все существующие частицы: фермионы, бозоны и скалярные частицы. В рамках теории «Великого объединения» хорошо объясняются многие очень важные явления, в частности такие, как наблюдаемая глюонная асимметрия Вселенной, малая ненулевая масса покоя нейтрино, квантование электрического заряда и существование решений типа магнитных монополей Дирака. По последним данным, среднее время жизни протона составляет более 1,6•1033 лет. Доказательство нестабильности протона явилось бы открытием фундаментальной важности. Однако пока этот распад не зафиксирован. Ученые надеются, что дальнейшее развитие моделей «Великого объединения» приведет к объединению всех взаимодействий, включая и гравитационное (суперобъединение). Но это – дело будущего.
В микрофизике известна и играет важную роль некая фундаментальная длина, называемая планковской, или гравитационной, длиной – lg
= 1,6–33 см. Считается, что длины меньше планковской в природе не существует. Совместно с планковским временем tg
~ 1,6•10–43с они составляют пространственно-временные кванты, которые призваны лечь в основу будущей квантовой теории гравитации. По мнению академика В.Л. Гинзбурга, физический смысл длины lg заключается в том, что при меньших масштабах уже нельзя пользоваться классической релятивистской теорией гравитации и, в частности, общей теорией относительности (ОТО), построение которой было завершено Эйнштейном в 1915 г.
В настоящее время наименьший «прицельный параметр», достигнутый на современных ускорителях, составляет lf ~ 10 –17 см. Таким образом, можно заключить, что вплоть до расстояний lf ~ 10 –17 см и времен lf/c ~ 10–27 с существующие пространственно-временные координаты справедливы. Значение lf
отличается от значения lg на целых 16 порядков, поэтому вопрос о фундаментальной длине еще остается актуальным для науки.
В первой половине XX в., когда объектами изучения микрофизики были атом, а затем атомное ядро, для того чтобы понять поведение электронов в атомах, пришлось совершить подлинную революцию в науке – создать квантовую механику. Микрофизика занимала тогда в естествознании совершенно особое место. Благодаря ее успехам мы смогли разобраться в строении вещества. Микрофизика – это фундамент современной физической науки.

Оставьте комментарий!
Вы должны быть авторизированы чтобы оставлять комментарии.